الورم الصماوي الصماوي المتعدد من النوع 1 (MEN1)
ما هي الأورام الصماوية المتعددة من النوع 1 (MEN1)؟ الأورام الصماوية المتعددة من النوع 1 هي مرض وراثي نادر، يمكن فيه ظهور أورام كثيرة (متعددة) (تكوّنات أورام) في الأعضاء (الصماوية) المنتجة للهرمونات بالإضافة إلى أورام غير صماوية (مثل الأورام الشحمية). من حيث المبدأ، يمكن للأورام غير الصماوية أن تنشأ في أي مكان بالجسم، توجد به أنسجة منتجة للهرمونات وشبيهة بالأعصاب. يتم تمييز MEN1 سريريًا من خلال ظهور أورام في الغدد الجار درقية، والغدة النخامية، وجزء من البنكرياس. بالنسبة لمريض MEN-1 فعادةً ما يتأثر اثنان من هذه الأعضاء على الأقل.


أورام الغدد الجار درقية والغدة النخامية تكون حميدة على الدوام تقريبًا. أورام البنكرياس تكون حميدة على الأغلب، لكنها يمكن أن أيضًا أن تكون خبيثة أو تتدهور مع مرور الوقت. إضافةً إلى ذلك، يظهر لدى مرضى MEN1 أورام في قشرة الغدة الكظرية وفي الغدة الزعترية والقصبات الهوائية والجهاز المعدي/المعوي وكذلك في الجلد (الأورام الشحمية = أورام الأنسجة الدهنية أو الأورام الليفية الوعائية = أورام النسيج الضام).
تتسبب الأورام المنتجة للهرمونات في فرط النشاط للعضو المعني مع الأعراض السريرية المقابلة (على سبيل المثال، يؤدي فرط نشاط الغدد الجار درقية إلى زيادة إفراز هرمون الدريقات مما يؤدي إلى زيادة نسبة الكالسيوم في الدم، وبالتالي ظهور حصوات في الكلى وإزالة الكلس من العظام على سبيل المثال). تحدث MEN1 لدى 1-3 أشخاص من بين كل 100000 شخص من إجمالي السكان. تتطور أعراض المرض لدى 80 % من المصابين وراثيًا أو تحدث لهم تغيرات في القيم المعملية قبل الوصول إلى 50 عامًا.
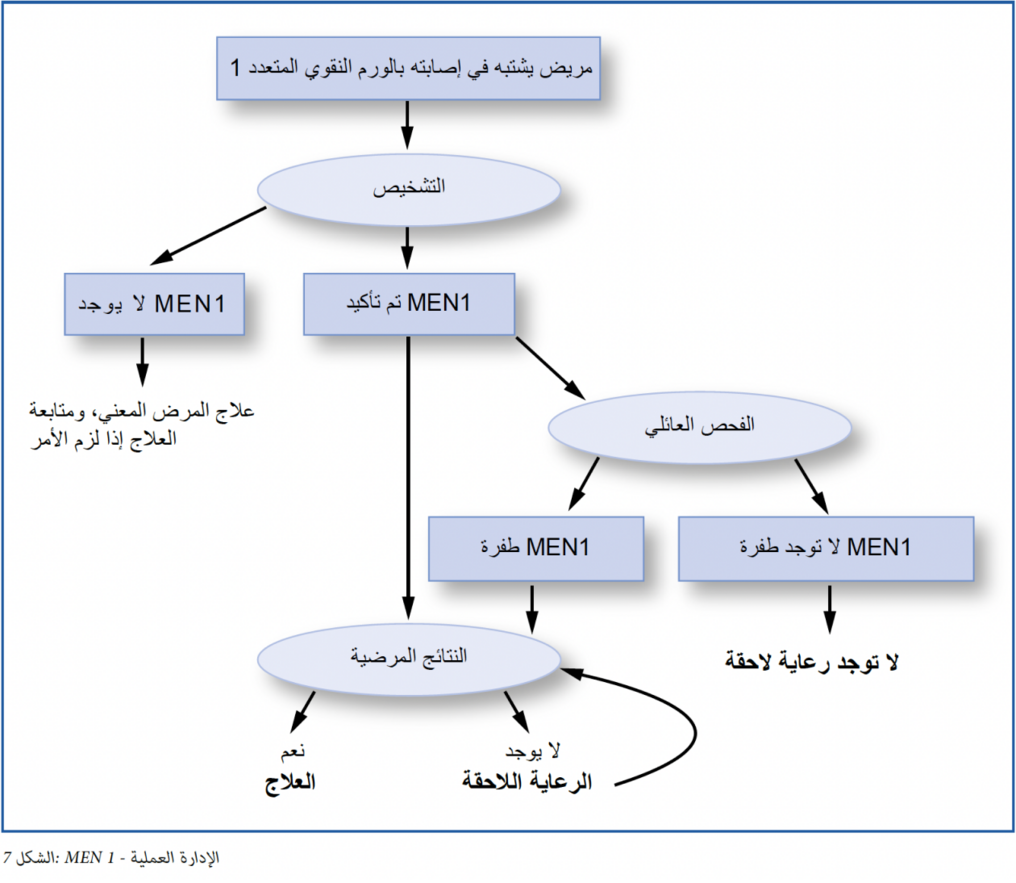
يمكن أن يظهر أي ورم من الأورام لدى الأشخاص بغض النظر عن وجود مرض وراثي. لكن عند تكوّن اثنين على الأقل من الأورام المذكورة في الوقت نفسه أو في وقت متداخل لدى أحد الأشخاص فإن هذا الأمر يبرر الاشتباه في تشخيص MEN1.
إذا كان قد تم تشخيص هذا المرض بالفعل لدى أحد الأقارب، فإن ظهور أحد الأورام العصبية الصماوية يُعد علامة على وجود MEN1.
ما هي الأعراض الرئيسية لـ MEN1، وكيف تنشأ؟
تكون الأعراض متنوعة للغاية وتعتمد على العضو المصاب. تُنتج الأورام الصماوية الهرمونات بشكل مفرط في المعتاد. وهذا الإنتاج الزائد غير المتحكم فيه للهرمونات يؤدي إلى أعراض شديدة التنوع. في المعتاد تنمو الأورام الصماوية ببطء شديد، وتتطور الأعراض بشكل تدريجي ويمكن تتبع أثرها لفترات طويلة. ويمكن أن تظهر أعراض مختلفة تبعًا للعضو المتضرر.
كيف يتم تشخيص MEN1؟
يمكن اكتشاف الطفرات لدى > 90 % من جميع مرضى
MEN-1 l أكثر من 500 طفرة مختلفة معروفة مع مرض MEN-1 l التحليل الجيني معقد للغاية l حتى الآن لا توجد أي علاقة واضحة بين نوع الطفرة وخطورة/شكل مرض MEN-1. يؤدي ظهور أورام متزامنة أو منفصلة في عضوين اثنين على الأقل من الأعضاء المذكورة (الغدد ال درقية، والغدة النخامية، والبنكرياس) إلى الاشتباه في تشخيص MEN1. كذلك فإن الاكتشاف العَرَضي لأربع غدد جار درقية متضخمة عند إجراء عملية جراحية لفرط نشاط الغدد الجار درقية ينبغي أن يؤدي إلى التفكير في متلازمة MEN. إذا كان قد تم تشخيص هذا المرض بالفعل لدى أحد الأقارب، فإن ظهور ورم صماوي واحد يُعد علامة على وجود MEN1.
يرجع السبب في تطور الأورام المختلفة عند الإصابة بمرض MEN1 إلى تغير (طفرة) في جين MEN-1. وهذا الجين يُشفِّر بروتين (المينين) المسؤول عن تنظيم نمو الخلايا. حدوث طفرة في جين MEN-1 يؤدي إلى بروتين غير وظيفي، لا يستطيع القيام بمهمته في كبح النمو (كبت الورم). فتنمو الخلايا بشكل غير متحكم فيه ويحدث الورم. تم التعرف حتى الآن على أكثر من 500 طفرة مختلفة في جين MEN-1، تؤدي إلى متلازمة MEN-1.
منذ منتصف عام 1997 يتوفر اختبار جيني يمكنه اكتشاف الطفرات في جين MEN-1. ويمكن من خلال هذا الاختبار الجيني فحص المرضى المشتبه في إصابتهم بمرض MEN1، وبالتالي يمكن بشكل واضح تأكيد التشخيص المشتبه به للمريض المعني. علاوةً على ذلك يمكن أن نصف
بوضوح ما إذا كان أفراد العائلة حاملين للجين أم لا، وبالتالي معرفة مدى وجود خطر الإصابة بمرض MEN-1 من عدمه. من الضروري الحصول على مشورة طبية تفصيلية قبل إجراء الاختبار الجيني.
الوقاية/الرعاية اللاحقة لمرضى MEN-1
يوصى بإجراء فحوصات الكشف المبكر المنتظمة للبحث عن أمراض الأعضاء المحتملة لدى مرضى MEN-1 ولدى الأشخاص الذين يحملون الجينات الوراثية المعنية. إن الأورام المكتشفة في الوقت المناسب يمكن علاجها بنجاح، ومنع ظهور الأعراض الشديدة.
الأورام الصماوية في الغدد الجار درقية
الجراحة
في المعتاد تتأثر الأربع غدد الجار درقية كلها عند الإصابة بفرط نشاط الغدد الجار درقية الأولي المرتبط بمرض MEN-1، وذلك بدرجات متفاوتة (ما يُعرف باسم التضخم غير المتماثل). علاوةً على ذلك، فمن غير النادر وجود غدد جار درقية زائدة - على الأغلب في الغدة الزعترية - في التجويف العلوي الأمامي للصدر. وإحدى الخصوصيات الإضافية هنا هي أنه على الرغم من الجراحة، يمكن أن تحدث عودة للمرض (انتكاس) مع ما يصل إلى 30 % من الحالات.
في حالة وجود فرط نشاط الغدد الجار درقية الأولي (سواء زيادة الكالسيوم أو هرمون الدريقات في الدم) فعلى الأغلب يكون هذا مؤشرًا على إجراء عملية جراحية.
ينبغي إجراء العملية الجراحية في مركز عن طريق جراح غدد صماء خبير، بحيث يمكن أيضًا الاحتفاظ بأنسجة الغدة الجار درقية مجمدة، وذلك لعدة أسباب:
نظرًا لأن أنسجة الغدة الجار درقية مريضة، فيجب استئصالها بشكل جذري قدر الإمكان، إلا أنه من الناحية الأخرى ينبغي أيضًا ترك أنسجة كافية لضمان استقلاب الكالسيوم الطبيعي.
في حالة ترك الكثير من الأنسجة المريضة في منطقة الرقبة، تحدث عودة للمرض (انتكاس) في نسبة عالية من الحالات، والتي لا يمكن علاجها إلا في ظل ظروف صعبة ومحفوفة بالمضاعفات.
يجب وضع هذا الأمر في الاعتبار عند إجراء العملية الجراحية. فمن ناحية، يجب على الجراح استئصال أنسجة كافية لعلاج المرض، إلا أنه يجب عليه من الناحية الأخرى إبقاء أنسجة كافية حتى لا يضطر المريض إلى الاعتماد على العقاقير بشكل دائم.
يؤدي ذلك إلى الطرق الجراحية المجربة التالية:
- ما يُعرف باسم استئصال الغدد الجار درقية الجزئي مع إبقاء بقايا ذات حجم طبيعي تقريبًا من الأنسجة الغدية والإزالة الإضافية للغدة الزعترية من منطقة الرقبة (استئصال الغدة الزعترية عبر العنق). ينبغي الاحتفاظ بجزء من أنسجة الغدد الجار درقية المستأصلة مجمدة (محفظة بالتبريد)، حتى يمكن إذابتها وإعادة غرسها في الجسم عند الحاجة.
- الاستئصال الكامل لأنسجة الغدد الجار درقية في منطقة الرقبة مع الاستئصال الإضافي للغدة الزعترية عبر العنق وغرس أجزاء من الأنسجة الغدية المستأصلة في عضلات الساعد في الوقت نفسه (يمكن بدلاً من ذلك غرسها في عضلة الرقبة السطحية). وفي هذه الحالة أيضًا ينبغي الاحتفاظ بالأنسجة مجمدة، حتى يمكن إعادة غرسها عند الحاجة.
إذا تمت العملية عن طريق جراح خبير تكون الطريقتان متكافئتين تقريبًا.
تحافظ طريقة غرس أنسجة الغدة الجار درقية في عضلات الساعد (أو الرقبة) على إنتاج الجسم الذاتي من هرمون الدريقات. وفي حالة تضخم الأنسجة من جديد وحدوث فرط إنتاج لهرمون الدريقات (انتكاس) يمكن في معظم الحالات استئصال النسيج بسهولة نسبية.
الأورام الصماوية في الغدة النخامية: العلاج بالعقاقير:
مع الورم الحميد المنتج للبرولاكتين: محفزات الدوبامين مثل برافيديل (بروموكريبتين) أو دوستينكس (كابرجولين) أو نوربرولاك (كويناجولايد)، التي تكبح إنتاج البرولاكتين ويمكنها التأثير على نمو الورم.
مع الورم الحميد المنتج لهرمون النمو: نظائر السوماتوستاتين مثل Sandostatin LAR® (أوكتريوتيد) أو Somatuline® Autogel (لانريوتيد)، الذي يمنع إنتاج هرمون النمو والهرمونات الأخرى. ويتم حقنه في المعتاد على هيئة مستحضرات مَدْخَرية على فترات شهرية. دواء جديد هو: Somavert® (بيجفيسومانت)، الذي يحظر مستقبلات هرمون النمو. ومن خلال حظر المستقبلات تمنع المادة الفعالة هرمون النمو من التأثير. يتم استخدام Somavert® مع المرضى الذين لا يستجيبون بشكل جيد لنظائر السوماتوستاتين.
الجراحة
إن أورام الغدة النخامية المنتجة لهرمون ACTH وغير النشطة هرمونيًا تكاد لا تستجيب للعقاقير المتاحة حاليًا على الإطلاق. ولهذا السبب يتم إجراء الاستئصال الجراحي عند وجود ضرورة طبية. ينطبق هذا الأمر بشكل طبيعيي على الأورام المنتجة لهرمون ACTH وعلى الأورام التي تُسبب أعراضًا (مثل اضطرابات الرؤية) بسبب حجمها. وعلاوةً على ذلك فإن العديد من المراكز ما تزال تعتبر إجراء العملية الجراحية هو الخيار الأول مع الأورام المنتجة لهرمون النمو. وعلى أية حال، يجب هنا إجراء العملية الجراحية في مركز متخصص في الغدة النخامية.
العلاج بالأشعة
بالنسبة للأورام الفردية التي لا يمكن التحكم بها جراحيًا ولا باستخدام العقاقير، تُعد هذه دلالة على الحاجة إلى استخدام العلاج بالأشعة. وينبغي أن يتم تحديد هذه الدلالة الدقيقة بشكل متعدد التخصصات (على سبيل المثال طبيب الغدد الصماء، وجراح الأعصاب، وأخصائي العلاج الإشعاعي). العلاج I 29 أورام GEP الصماوية: الاستئصال الجراحي (القطع) للورم، اعتمادًا على نوع الورم، وحجمه، ومكانه (الموضع)
العلاج بالعقاقير:
الورم الجاستريني: على سبيل المثال بانتوزول أو أوميبرازول، الذي يقلل من إنتاج حمض المعدة، وبالتالي يقلل من تكوّن ونمو القرحة.
الورم الإنسوليني: نظائر السوماتوستاتين (انظر الصفحة السابقة)؛ ديازوكسيد يمكن أن يمنع نقص سكر الدم. سرطان الغدد الصماوية العصبية (الورم السرطاوي): ينبغي استئصال هذه الأورام جراحيًا، إن أمكن؛ يُستخدم العلاج بالعقاقير في تخفيف الأعراض وإبطاء نمو الورم.
أورام البنكرياس غير النشطة هرمونيًا: العملية الجراحية، إذا كان ذلك مناسبا؛ نظائر السوماتوستاتين، وعقاقير أخرى، وطريقة العلاج بالطب النووي.
يتم اكتشاف العديد من أورام GEP باستخدام التصوير الطبي المعتمد على السوماتوستاتين (على سبيل المثال Octreoscan، وDOTA-TOC). في حالة وجود امتصاص واضح للمادة المشعة، فيمكن أيضًا استخدام ذلك علاجيًا في كثير من الأحيان. أورام الغدة الكظرية: كما هو مذكور أعلاه، يجب تحديد الدلالة على ضرورة العملية الجراحية بشكل فردي. ينبغي إجراء العملية الجراحية في مركز متخصص تبعًا لحجم الورم ومدى الاشتباه في وجود ورم خبيث عن طريق تدخل جراحي محدود (جراحة ثقب المفتاح) أو إجراء مفتوح (شق البطن).
بدعم كريم من

